 Ein Diamant ist für die Ewigkeit. Seit de Beers Ende der 1930er Jahre mit diesem Slogan
wirbt, sind Verlobungsringe mit einem Diamanten – von den Amerikanern the
rock (= Fels) genannt – nicht nur ein Heiratsversprechen, sondern stellten
vor allem in früheren Zeiten für die Beschenkte auch eine finanzielle Bürgschaft
für den Fall dar, dass es zum Ehebund nicht kommen würde.
Ein Diamant ist für die Ewigkeit. Seit de Beers Ende der 1930er Jahre mit diesem Slogan
wirbt, sind Verlobungsringe mit einem Diamanten – von den Amerikanern the
rock (= Fels) genannt – nicht nur ein Heiratsversprechen, sondern stellten
vor allem in früheren Zeiten für die Beschenkte auch eine finanzielle Bürgschaft
für den Fall dar, dass es zum Ehebund nicht kommen würde.
Diamanten werden wegen ihrer Eigenschaften vielfältig verwendet. Aufgrund ihrer Transparenz brechen sie wie kein anderes Material sichtbares Licht, wodurch sie als Schmuckstücke begehrt sind. Da Diamanten in der Natur außerordentlich selten vorkommen und darüber hinaus ihr Vertrieb durch das Diamantenkartell um de Beers genau kontrolliert und gesteuert wird, sind sie kostbar und werden seit Jahrzehnten auch als solide Geldanlage gepriesen.
Die härteste Währung der Welt hat in der Tat eine konstante Wertsteigerung von etwa fünf Prozent jährlich erfahren. Diamanten sind aber tatsächlich aufgrund ihrer außerordentlichen Härte – im physikalischen Sinn – einzigartig. Diese Eigenschaft macht man sich für Bohrer zu nutze, da Diamanten in der Lage sind, jedes noch so harte Felsgestein zu durchdringen.
 Diamanten bestehen aus nichts anderem als Kohlenstoff. Kohlenstoff ist auf der Erde in
großen Mengen in drei Arten – die Modifikationen Graphit, Diamant und
Buckyballs – vorhanden. Am häufigsten (mehr als 99,9 Prozent) kommt Kohlenstoff
auf der Erde als Kohle oder Graphit vor und wird zum Heizen von Öfen oder Kraftwerken
und zum Schreiben und Malen in Bleistiftminen verwendet.
Diamanten bestehen aus nichts anderem als Kohlenstoff. Kohlenstoff ist auf der Erde in
großen Mengen in drei Arten – die Modifikationen Graphit, Diamant und
Buckyballs – vorhanden. Am häufigsten (mehr als 99,9 Prozent) kommt Kohlenstoff
auf der Erde als Kohle oder Graphit vor und wird zum Heizen von Öfen oder Kraftwerken
und zum Schreiben und Malen in Bleistiftminen verwendet.
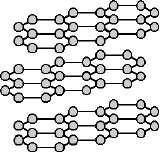
Graphit ist aus Schichten von Kohlenstoffatomen angeordnet, die sich in Ebenen übereinander stapeln. Jedes Kohlenstoffatom bildet drei Bindungen zu benachbarten Kohlenstoffatomen aus, das verbleibende vierte Elektron jedes Kohlenstoffatoms ist frei in der Ebene beweglich. Diese freien Elektronen absorbieren sehr effektiv Licht, wodurch sich die pechschwarze Farbe von Kohle erklärt.
Nähern sich diese Schichten einander, bilden die freien Elektronen der Kohlenstoffatome zwischen den Ebenen Bindungen aus, wodurch ein außerordentlich festes und nun auch transparentes Netzwerk von Kohlenstoffatomen hergestellt wird, das so genannte Diamantgitter.
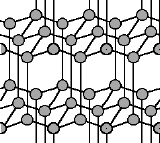 Übt man also sehr starken Druck auf Graphit aus, kommt es zu der eben beschriebenen
Annäherung der Schichten. Auf diese Weise kann man also billige Kohle in Diamanten
umwandeln – ein Verfahren, das vor mehr als 50 Jahren zunächst von Forschern
des Allmana Svenska Elektriska Aktiebolaget Labors in Stockholm und
kurze Zeit später unabhängig von General Electric entwickelt und zur
Herstellung von Industriediamanten genutzt wurde.
Übt man also sehr starken Druck auf Graphit aus, kommt es zu der eben beschriebenen
Annäherung der Schichten. Auf diese Weise kann man also billige Kohle in Diamanten
umwandeln – ein Verfahren, das vor mehr als 50 Jahren zunächst von Forschern
des Allmana Svenska Elektriska Aktiebolaget Labors in Stockholm und
kurze Zeit später unabhängig von General Electric entwickelt und zur
Herstellung von Industriediamanten genutzt wurde.
Allerdings waren die so erhaltenen Diamanten nur sehr klein und von geringer Reinheit, so dass sie für die Schmuckindustrie nicht attraktiv waren und somit auch keinen besonderen Wert darstellten. Doch erlaubt inzwischen die Verbesserung bestehender und die Entwicklung neuer Verfahren die Herstellung von Diamanten in so hervorragender Qualität, dass selbst ein Fachmann sie von natürlichen nicht unterscheiden kann.
Bildnachweis:
Diamanten (Wikimedia Commons by Mario Sarto)