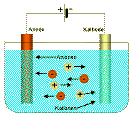
 In der International Space Station ISS wird Sauerstoff durch Elektrolyse aus H2O erzeugt, CO2 wird an (immerhin regenerierbaren) Zeolithabsorbern gebunden, die den in Waschmitteln zur Entkalkung verwendeten Zeolithen sehr ähneln. Damit ist man von einem Kreislauf immer noch weit entfernt, das bei der Elektrolyse entstehende H2 und das während der Regeneration vom Zeolith desorbierte CO2 werden einfach ins All gepustet.
In der International Space Station ISS wird Sauerstoff durch Elektrolyse aus H2O erzeugt, CO2 wird an (immerhin regenerierbaren) Zeolithabsorbern gebunden, die den in Waschmitteln zur Entkalkung verwendeten Zeolithen sehr ähneln. Damit ist man von einem Kreislauf immer noch weit entfernt, das bei der Elektrolyse entstehende H2 und das während der Regeneration vom Zeolith desorbierte CO2 werden einfach ins All gepustet.
Viel besser wäre es, wenn man diese beiden "Abfallprodukte" gemäß der Gleichung
4 H2 + CO2 → CH4 + 2 H2O
miteinander reagieren lassen würde; auf diese Weise könnte der ganze Sauerstoff und immerhin die Hälfte des Wasserstoffs aus dem ursprünglich elektrolysierten Wasser zurückgewonnen werden. Dieser Prozess lässt sich tatsächlich realisieren, wenn man einen geeigneten Katalysator verwendet, der aus fein verteiltem Ruthenium auf einem Aluminiumoxidträger besteht. Für diesen so genannten "Sabatier-Reaktor" ist auf der ISS immerhin schon ein Platz für den späteren Einbau vorgesehen.
All diese Prozesse sind aber nicht wirklich robust und notfallsicher: Strom und Regelungssysteme können ausfallen, Sauerstofftanks leckschlagen. Für Notfälle verlässt man sich da immer noch auf chemisch gebundenen, leicht freisetzbaren Sauerstoff, der zum Beispiel in so genannten "Sauerstoffkerzen" mitgeführt werden kann. Diese bestehen aus Natriumchlorat NaClO3, das sich nach Zündung durch eine Bariumperoxid/Eisenpulvermischung gemäß
NaClO3 → NaCl + 1.5 O2
 unter Sauerstofffreigabe zersetzt. Bevor die Elektrolyseeinheit in Betrieb genommen wurde, haben die Astronauten in der ISS mit genau diesen Systemen geatmet.
unter Sauerstofffreigabe zersetzt. Bevor die Elektrolyseeinheit in Betrieb genommen wurde, haben die Astronauten in der ISS mit genau diesen Systemen geatmet.
Übrigens: wer fliegt, verlässt sich für den Notfall auf die gleiche Reaktion; man muss bei den im Fall einer Dekompression von oben herunterfallenden Sauerstoffmasken genau deshalb einmal kräftig an der Leine ziehen, um die Disproportionierung des Chlorats zu zünden.