 Der Einsatz von Katalysatoren ist der Königsweg in der Entwicklung von umweltschonenden, chemischen Prozessen. Katalysatoren erlauben den Ablauf von chemischen Reaktionen mit großer Geschwindigkeit unter besonders milden Bedingungen ohne Entstehung von Abfall. Sie werden dabei selbst nicht verbraucht und sind somit unverwüstliche Arbeitsvehikel, die immer wieder verwendet werden können. Einen Artikel über die Grundlagen der Katalyse finden Sie in diesem Portal.
Der Einsatz von Katalysatoren ist der Königsweg in der Entwicklung von umweltschonenden, chemischen Prozessen. Katalysatoren erlauben den Ablauf von chemischen Reaktionen mit großer Geschwindigkeit unter besonders milden Bedingungen ohne Entstehung von Abfall. Sie werden dabei selbst nicht verbraucht und sind somit unverwüstliche Arbeitsvehikel, die immer wieder verwendet werden können. Einen Artikel über die Grundlagen der Katalyse finden Sie in diesem Portal.
 Die Wirklichkeit ist leider keineswegs so ideal, wie im vorigen Absatz geschildert. Katalysatoren ermüden mit der Zeit, so dass für viele Prozesse recht beträchtliche Katalysatormengen eingesetzt werden müssen, um vernünftige Umsätze in chemischen Prozessen zu erzielen. Weiterhin müssen vor allem Metallkatalysatoren, etwa auf Basis von Nickel, aufgrund deren allergenen Potentzials vollständig vom Produkt entfernt werden. Eine wichtige Strategie ist daher die so genannte Immobilisierung von Katalysatoren, bei
Die Wirklichkeit ist leider keineswegs so ideal, wie im vorigen Absatz geschildert. Katalysatoren ermüden mit der Zeit, so dass für viele Prozesse recht beträchtliche Katalysatormengen eingesetzt werden müssen, um vernünftige Umsätze in chemischen Prozessen zu erzielen. Weiterhin müssen vor allem Metallkatalysatoren, etwa auf Basis von Nickel, aufgrund deren allergenen Potentzials vollständig vom Produkt entfernt werden. Eine wichtige Strategie ist daher die so genannte Immobilisierung von Katalysatoren, bei  der letztere an einen Träger angebunden werden. Als Träger verwendet man in der Regel Polymere, die in den Lösungsmitteln, in denen die Reaktionen durchgeführt werden, unlöslich sind. Am Ende der Reaktion kann man dann die Polymer-gebundenen Katalysatorendurch einfaches Abfiltrieren aus der Reaktionsmischung entfernen und in einer nächsten Reaktion erneut verwenden.
der letztere an einen Träger angebunden werden. Als Träger verwendet man in der Regel Polymere, die in den Lösungsmitteln, in denen die Reaktionen durchgeführt werden, unlöslich sind. Am Ende der Reaktion kann man dann die Polymer-gebundenen Katalysatorendurch einfaches Abfiltrieren aus der Reaktionsmischung entfernen und in einer nächsten Reaktion erneut verwenden.
In unserer Arbeitsgruppe beschäftigen wir uns mit bislang mit einem in der Katalyse bislang erst wenig genutztem Konzept: Wir verwenden magnetische Nanopartikeln als Träger für Katalysatoren. Dies besitzt eine Reihe von Vorteilen: Aufgrund ihres kleinen Durchmessers von etwa 10-50 nm (ein menschliches Haar ist etwa 3000 mal dicker) können sie in Reaktionslösung effektiv verteilt - dispergiert - werden. Besonders einfach geschieht dies durch einen außerhalb des Reaktionsgefäßes rotierenden Magneten (Magnetrührer), die Verwirbelung wird dann noch durch einen schwach magnetischen Rührstab im Reaktionsgefäß unterstützt (s. nebenstehendes Video, Quicktime-plugin erforderlich). Dagegen sind konventionelle polymere Träger nicht stabil genug, um ein mechanisches Rühren im Reaktionsgefäß unbeschadet zu überstehen. Die Oberfläche der Nanopartikel ist weiterhin gut zugänglich, so dass darauf angebrachte Katalysatoren ihre Wirkung effektiv enfalten können. Durch  Anlegen eines äußeren Magnetfelds - im einfachsten Fall bringt man einen starken Magneten an das Reaktionsgefäß - können die Nanopartikel in Bruchteilen von Sekunden fixiert werden, woraufhin die Reaktionslösung einfach abgegossen - man spricht von dekantieren - werden kann. Im Gegensatz dazu kann das Trennen einer Reaktionslösung von einem an ein Polymer gebundenen Katalysator sehr zeitaufwendig sein.
Anlegen eines äußeren Magnetfelds - im einfachsten Fall bringt man einen starken Magneten an das Reaktionsgefäß - können die Nanopartikel in Bruchteilen von Sekunden fixiert werden, woraufhin die Reaktionslösung einfach abgegossen - man spricht von dekantieren - werden kann. Im Gegensatz dazu kann das Trennen einer Reaktionslösung von einem an ein Polymer gebundenen Katalysator sehr zeitaufwendig sein.
Magnetische Nanopartikel besitzen einen Metallkern, besonders häufig wird hierfür preiswertes Eisen, Magnetit (Eisenoxid Fe3O4) oder Cobalt verwendet. Dieser Kern kann dann noch durch eine äußere Schutzschicht überzogen sein, was gerade für die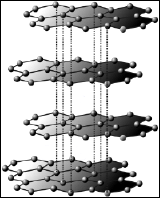 Verwendung in chemischen Reaktionen, in denen die Partikel in der Regel sehr harschen Reaktionsbedingungen (etwa hoher Temperatur, saurer oder basischer pH) ausgesetzt sind, von Vorteil ist. So verwenden wir in unserer Arbeitsgruppe Cobaltpartikel, die mit einigen Schichten aus Kohlenstoff überzogen sind. Diese Kohlenstoffschichten bestehen aus zweidimensionalen Graphenschichten, in denen jedes Kohlenstoffatom in einer wabenförmigen Sechringstruktur von drei anderen Kohlenstoffatomen umgeben ist. Da Kohlenstoff vier Bindungen ausbilden will, werden senkrecht zu der Kohlenstoffebene immer alternierend eine weitere, sogenannte π-Bindung gebildet, wodurch ein delokalisiertes π-Elektronensystem über die gesamte Kohlenstofffläche entsteht. Mehrere solcher einlagigen Schichten stapeln sich übereinander, so dass der Kohlenstoffüberzug der von uns verwendenten Nanopartikel im Prinzip einer Graphitschicht, dem Matierial der Bleistiftminen, entspricht.
Verwendung in chemischen Reaktionen, in denen die Partikel in der Regel sehr harschen Reaktionsbedingungen (etwa hoher Temperatur, saurer oder basischer pH) ausgesetzt sind, von Vorteil ist. So verwenden wir in unserer Arbeitsgruppe Cobaltpartikel, die mit einigen Schichten aus Kohlenstoff überzogen sind. Diese Kohlenstoffschichten bestehen aus zweidimensionalen Graphenschichten, in denen jedes Kohlenstoffatom in einer wabenförmigen Sechringstruktur von drei anderen Kohlenstoffatomen umgeben ist. Da Kohlenstoff vier Bindungen ausbilden will, werden senkrecht zu der Kohlenstoffebene immer alternierend eine weitere, sogenannte π-Bindung gebildet, wodurch ein delokalisiertes π-Elektronensystem über die gesamte Kohlenstofffläche entsteht. Mehrere solcher einlagigen Schichten stapeln sich übereinander, so dass der Kohlenstoffüberzug der von uns verwendenten Nanopartikel im Prinzip einer Graphitschicht, dem Matierial der Bleistiftminen, entspricht.
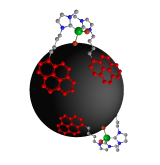 Eine große Herausforderung liegt in der effektiven Anbindung der Katalysatoren an die Graphen-beschichteten Nanopartikel. Da diese Kohlenstoffoberfläche sehr unreaktiv ist, ist es nicht leicht, eine Verbindung mit einem Katalysator zu erreichen. Doch die Kohlenstoffoberfläche hat eine interesante Eigenschaft, die wir hierfür ausnutzen konnten: Sie besitzt ein ausgedehntes System von über der Oberffäche verteilten Elektronen - man spricht von einem delokalisierten π-System. Nun ziehen sich π-Systeme gegenseitig an und bilden dabei, wie schon oben diskutiert, Stapel, man spricht vom π-stacking. Wir haben daher Katalysatoren konstruiert, die mit zwei Pyrenmolekülen, die ebenfalls ein delokalisiertes π-System besitzen (Abbildung, links in rot), ausgestattet sind. Zusammengebracht mit den Nanopartikeln stapeln sich jetzt
diese Pyrengruppen auf der Graphenoberfläche, die Verbindung von Nanopartikeln und Katalysatoren geht also durch diesen Trick quasi von selbst. Da Katalysatoren allein viel reaktiver sind als wenn sie an einen Träger gebunden sind, ist ein weiterer Vorteil dieses Verfahrens, dass die hier entwickelte Anbindung der Katalysatoren an die Kohlenstoff-beschichteten Nanopartikel reversibel ist: Bei höheren Temperaturen löst sich sich der Katalysator von der Oberfläche der Nanopartikel wieder ab, und
Eine große Herausforderung liegt in der effektiven Anbindung der Katalysatoren an die Graphen-beschichteten Nanopartikel. Da diese Kohlenstoffoberfläche sehr unreaktiv ist, ist es nicht leicht, eine Verbindung mit einem Katalysator zu erreichen. Doch die Kohlenstoffoberfläche hat eine interesante Eigenschaft, die wir hierfür ausnutzen konnten: Sie besitzt ein ausgedehntes System von über der Oberffäche verteilten Elektronen - man spricht von einem delokalisierten π-System. Nun ziehen sich π-Systeme gegenseitig an und bilden dabei, wie schon oben diskutiert, Stapel, man spricht vom π-stacking. Wir haben daher Katalysatoren konstruiert, die mit zwei Pyrenmolekülen, die ebenfalls ein delokalisiertes π-System besitzen (Abbildung, links in rot), ausgestattet sind. Zusammengebracht mit den Nanopartikeln stapeln sich jetzt
diese Pyrengruppen auf der Graphenoberfläche, die Verbindung von Nanopartikeln und Katalysatoren geht also durch diesen Trick quasi von selbst. Da Katalysatoren allein viel reaktiver sind als wenn sie an einen Träger gebunden sind, ist ein weiterer Vorteil dieses Verfahrens, dass die hier entwickelte Anbindung der Katalysatoren an die Kohlenstoff-beschichteten Nanopartikel reversibel ist: Bei höheren Temperaturen löst sich sich der Katalysator von der Oberfläche der Nanopartikel wieder ab, und  bewirkt die Reaktion zwischen Molekülen, etwa wie in der rechten Animation geziegt die Caroboxylierung von Aromaten. Nach Abkühlen der Reaktionsmischung "landet" der Katalyator aufgrund des π-stackings wieder sicher auf den Nanopartikeln (s. Animation rechts) und lässt sich durch Anlegen eines Magneten effektiv von den Reaktionsprodukten abtrennen und anschließend erneut verwenden. Auf diese Weise konnten wir die Effizienz von teuren Palladiumkatalysatoren um etwa das 20 fache steigern.
bewirkt die Reaktion zwischen Molekülen, etwa wie in der rechten Animation geziegt die Caroboxylierung von Aromaten. Nach Abkühlen der Reaktionsmischung "landet" der Katalyator aufgrund des π-stackings wieder sicher auf den Nanopartikeln (s. Animation rechts) und lässt sich durch Anlegen eines Magneten effektiv von den Reaktionsprodukten abtrennen und anschließend erneut verwenden. Auf diese Weise konnten wir die Effizienz von teuren Palladiumkatalysatoren um etwa das 20 fache steigern.
Die gesamte Studie wurde in der Zeitschrift Angewandte Chemie veröffentlicht. Besonders gefreut hat uns, dass unsere Arbeit auch das Titelbild des Journals zierte. Wenn Sie an einem Sonderdruck interessiert sind, schreiben Sie mir.
Artikel zum Thema:
S. Wittmann, A. Schätz, R. N. Grass, W. J. Stark, O. Reiser, Angew. Chem. 2010, 122, 1911-1914; Angew. Chem. Int. Ed. 2010, 49, 1867-1870; Web Edition: http://dx.doi.org/10.1002/anie.200906166
Bildnachweis:
Graphen-Graphit-Gitter: Wikimedia Commons von Anton und Mattman723