 Unser Leben basiert auf Chemie! Tausende Proteine befinden sich in jeder unserer Zellen und steuern deren Funktion, in dem sie Moleküle erkennen, binden und miteinander zur Reaktion bringen. Gerät diese Maschinerie aus dem Tritt, entstehen Krankheiten wie Krebs oder Alzheimer. Die Aufklärung solcher Vorgänge ist daher von großer Wichtigkeit, aber aufgrund der großen Zahl dieser Biomoleküle in jeder Zelle und der vielen gleichzeitig stattfindenen Prozesse sehr schwierig. Methoden, die dies erlauben, sind in den vergangenen Jahren immer wieder mit Nobelpreisen ausgezeichnet worden, etwa 2002 für die Strukturbestimmung von Proteinen durch Massenspektrometrie und NMR-Spektroskopie. Doch lassen sich mit diesen Methoden direkte Abläufe von in den Zellen stattfindenen Vorgängen nur eingeschränkt untersuchen.
Unser Leben basiert auf Chemie! Tausende Proteine befinden sich in jeder unserer Zellen und steuern deren Funktion, in dem sie Moleküle erkennen, binden und miteinander zur Reaktion bringen. Gerät diese Maschinerie aus dem Tritt, entstehen Krankheiten wie Krebs oder Alzheimer. Die Aufklärung solcher Vorgänge ist daher von großer Wichtigkeit, aber aufgrund der großen Zahl dieser Biomoleküle in jeder Zelle und der vielen gleichzeitig stattfindenen Prozesse sehr schwierig. Methoden, die dies erlauben, sind in den vergangenen Jahren immer wieder mit Nobelpreisen ausgezeichnet worden, etwa 2002 für die Strukturbestimmung von Proteinen durch Massenspektrometrie und NMR-Spektroskopie. Doch lassen sich mit diesen Methoden direkte Abläufe von in den Zellen stattfindenen Vorgängen nur eingeschränkt untersuchen.
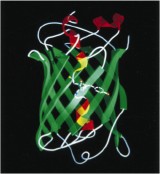
 Licht in dieses Dunkel brachte ein natürlich vorkommendes Protein: Bereits 1955 wurde das Phänomen der Bioluminiszens - die Erzeugung von Licht mit Hilfe von chemischen Reaktionen als Energielieferant – von den Davenport und Nicol für die im Nordwestpazifik beheimatete Qualle Aequorea victoria beschrieben. Sieben Jahre später gelang dem Japaner Osamu Shimomura die Isolierung des hierfür verantwortlichen Moleküls, wofür er ein Drittel des diesjährigen Nobelpreises erhielt. Das grün fluoreszierende Protein (GFP) - das blaue Leuchten der Qualle erklärt sich doch Wechselwirkung mit einem weiteren Protein - besteht aus einer Kette aus 238 Aminosäuren, dem generellen Bauprinzip, dem Tausende von Proteinen folgen. Warum fluoresziert nun GFP, wodurch es zu einem einzigartigen Biomolekül wird?
Licht in dieses Dunkel brachte ein natürlich vorkommendes Protein: Bereits 1955 wurde das Phänomen der Bioluminiszens - die Erzeugung von Licht mit Hilfe von chemischen Reaktionen als Energielieferant – von den Davenport und Nicol für die im Nordwestpazifik beheimatete Qualle Aequorea victoria beschrieben. Sieben Jahre später gelang dem Japaner Osamu Shimomura die Isolierung des hierfür verantwortlichen Moleküls, wofür er ein Drittel des diesjährigen Nobelpreises erhielt. Das grün fluoreszierende Protein (GFP) - das blaue Leuchten der Qualle erklärt sich doch Wechselwirkung mit einem weiteren Protein - besteht aus einer Kette aus 238 Aminosäuren, dem generellen Bauprinzip, dem Tausende von Proteinen folgen. Warum fluoresziert nun GFP, wodurch es zu einem einzigartigen Biomolekül wird?
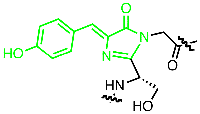 Tief im Inneren der Peptidsequenz von GFP sind drei Aminosäurebausteine durch die Faltung des Proteins so angeordnet, dass sie miteinander zu einer fluoreszierenden Einheit spontan reagieren können. Aus der Triade Serin-Tyrosin-Glycin wird so der farbgebende Chromophor p-Hydroxybenzylidenimidazolinon gebildet , dessen hoch-konjugiertes π-System die Voraussetzung für die Absorption von Licht und damit für Farbigkeit darstellt (Abbildung links, zur Darstellung der Reaktionssequenz anklicken). Das Besondere an fluoreszenten Verbindungen wie dem GFP ist, dass sie durch Licht einer Wellenlänge (rot) in einen angeregten Zustand versetzt werden, und daraufhinLicht einer anderen Wellenlänge (grün) abstrahlen. Dieser Prozess ist äußerst empfindlich, so dass das Aufspüren von fluoreszenten Molekülen durch Anregung mit einem Laser geeigneter Wellenlänge schon in nano- oder sogar picomolaren Konzentrationen gelingt, also die sprichwörtliche Nadel im Heuhaufen aufgespürt werden kann.
Tief im Inneren der Peptidsequenz von GFP sind drei Aminosäurebausteine durch die Faltung des Proteins so angeordnet, dass sie miteinander zu einer fluoreszierenden Einheit spontan reagieren können. Aus der Triade Serin-Tyrosin-Glycin wird so der farbgebende Chromophor p-Hydroxybenzylidenimidazolinon gebildet , dessen hoch-konjugiertes π-System die Voraussetzung für die Absorption von Licht und damit für Farbigkeit darstellt (Abbildung links, zur Darstellung der Reaktionssequenz anklicken). Das Besondere an fluoreszenten Verbindungen wie dem GFP ist, dass sie durch Licht einer Wellenlänge (rot) in einen angeregten Zustand versetzt werden, und daraufhinLicht einer anderen Wellenlänge (grün) abstrahlen. Dieser Prozess ist äußerst empfindlich, so dass das Aufspüren von fluoreszenten Molekülen durch Anregung mit einem Laser geeigneter Wellenlänge schon in nano- oder sogar picomolaren Konzentrationen gelingt, also die sprichwörtliche Nadel im Heuhaufen aufgespürt werden kann.
Martin Chalfie von der Columbia Universität in New York zeigte die Anwendungsmöglichkeiten von GFP für das Studium von Vorgängen in Zellen auf, wofür er ebenfalls mit einem Drittel des diesjährigen Nobelpreises ausgezeichnet wurde. Er erkannte, dass man GFP gebunden an beliebige andere Proteine durch Genexpression in lebenden Zellen exprimieren kann. Die Proteine werden durch das leuchtende, nicht toxische Anhängsel GFP in ihrer Funktion nicht gestört, so dass man deren Funktion und Wirkungsort nach Anregung anhand des ausgestrahlten fluoreszenten Lichts untersuchen kann.
Roger Y. Tsien von der Universität California, San Diego, dritter Nobelpreisträger für Chemie in diesem Jahr, leistete wegweisende Beiträge zum molekularen Verständnis von GFP. Darüber hinaus gelang es ihm, modifizierte GFP-Proteine herzustellen, die in anderen Farben leuchten, so dass man auch mehrere Vorgänge gleichzeitig untersuchen kann. Durch Variation der Wellenlänge des zur Anregung benötigten Lichts der GFP-Derivate, die daraufhin in unterschiedlichen Farben aufleuchten, gelingt es darüber hinaus, ein bestimmtes Protein exakt und ohne optische Störung durch andere GFP-markierte Proteine in seiner Funktion zu verfolgen.
Markierungen von Biomolekülen mit GFP in Zellen haben unser biochemisches Verständnis von Zellvorgängen revolutioniert. Das Verfolgen des Infektionsweges des AIDS Virus, die Aufklärung von Genexpressionen oder der Funktion von Neuronen sind nur einige Beispiele, die durch die Anwendung von GFP möglich wurden.
Bildnachweis
Proteinstruktur GFP: K. Brejc et al., Proc. Natl. Acad. Sci. USA 1997, 94, 2306.
Aequorea victoria: Sierra Blakely (Wikimedia Commons)
Artikel zum Thema:
Nobelpreis Chemie 2007 | Nobelpreis Chemie 2006 | Nobelpreis Chemie 2005 | Nobelpreis Chemie 2004 | Nobelpreis Chemie 2003 | Nobelpreis Chemie 2002 |Nobelpreis Chemie 2001 | Katalyse - was ist das?
DVD-Empfehlung
Der Nobel-Preis: Die grössten Entdeckungen der Wissenschaft
Buchempfehlung
Nobelpreise: Brisante Affären, umstrittene Entscheidungen (Erlebnis Wissenschaft)